FDA 监管部门对 ESG 的 AS2 提交
了解如何通过安全高效简化 FDA 监管提交 AS2 通道,支持大文件(VLF),增强进度跟踪,并完全控制您的制药数据。

什么是监管信息?
监管信息是指监管机构要求的数据、文档和其他材料,例如美国食品药品监督管理局 (FDA)、欧洲药品管理局(EMEA)或CDE、MHRA、厚生劳动省-以评估和监管医疗产品和实践。
产品信息
有关产品的详细信息,包括其成分、配方、制造 过程、预期用途、适应症、禁忌症和剂量。
临床数据
来自临床试验和研究的信息,以评估安全性和产品的功效。这可能包括研究方案、临床试验结果、 不良事件报告和药物警戒数据。
质量数据
与质量控制、制造流程和质量保证相关的数据 在产品生产过程中实施的措施。这可能包括制造记录、批次记录、稳定性数据和分析证书。
监管提交
向监管机构提交产品审批的文件,例如新药 申请(NDA)、生物制品许可申请(BLA)、上市前批准应用程序(PMA)和营销授权应用程序(MAA)。
标签和包装信息
商品标签和包装上提供的信息,包括处方信息、患者信息传单、包装说明书和标签,用于特定人群。
安全和风险信息
有关商品安全性的数据,包括不良事件报告、风险评估和风险管理计划

监管信息在监管审批流程中起着关键作用,因为 监管机构使用这些数据来评估商品的益处和风险,并 关于其审批、营销和上市后监督的明智决策。 遵守法规要求,准确、完整、及时地提交 监管信息对于获得和维护 监管部门批准至关重要 产品。
向 FDA 电子提交网关 (ESG) 的监管提交
食品和制药公司报告强制性 以及向 FDA 提交的与各种产品相关的可选信息,以满足监管和 报告要求。这些提交内容可能是关于不良事件、上市前和 上市后监管信息等
向 FDA 电子提交网关 (ESG) 的监管提交
食品和制药公司报告强制性 以及向 FDA 提交的与各种产品相关的可选信息,以满足监管和 报告要求。这些提交内容可能是关于不良事件、上市前和 上市后监管信息等
提交给 ESG 的大多数材料都直接提交给了器械和放射学中心健康(CDRH),然后提交给不良事件报告系统 (AERS)中心。 生物制品评价和研究 (CBER)和药物评价和研究中心(CDER) 的CDER。
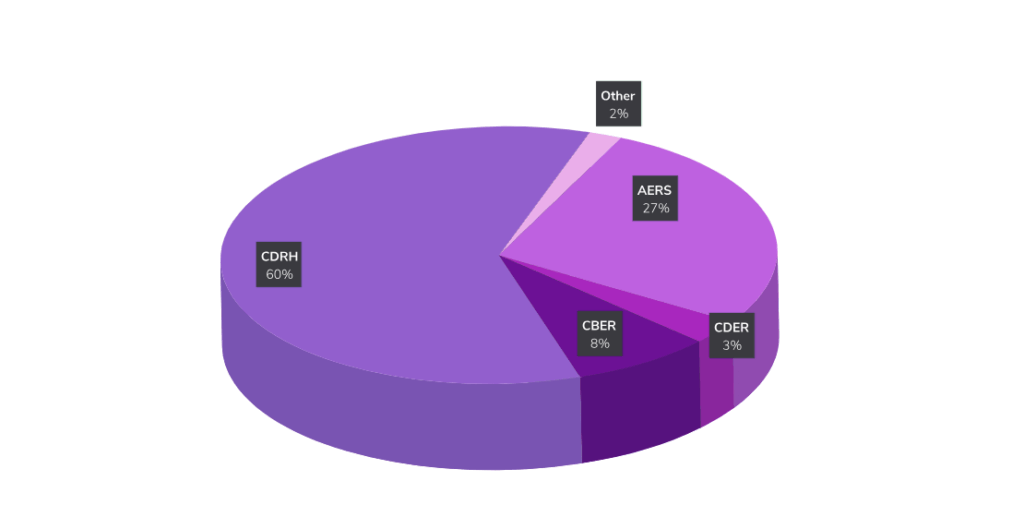
向CBER和CDER提交的文件需要使用电子通用技术文件(eCTD)格式提交,并且必须通过FDA ESG提交。AS2网关到网关FDA 建议对此类转移进行连接。
方案
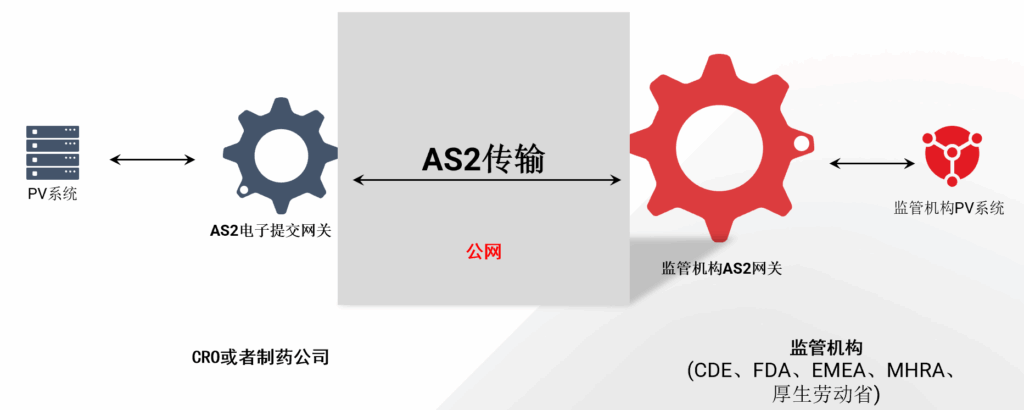
华瑞斯恩电子提交解决方案优势:
电子提交解决方案契合医疗行业电子化提交的需求,具备标准性、灵活性、安全性、可靠性等显著特点:
- 合规性与标准性:支持国际医药行业监管机构认可的 AS2 传输协议,充分满足合规性要求。
- 便捷的对接能力:支持 AS2 自定义传输属性,内置监管机构 AS2 对接参数模板,有效简化对接难度。
- 灵活的集成方式:支持多种传输协议实现与 PV 系统的灵活集成。
- 报文处理能力:支持E2B R2/R3。
- 可靠的系统部署:支持各种操作系统。
- 强大的本地支持:拥有经验非常丰富的本地团队,为客户提供强大的支持。